Opfolda
Ultimo aggiornamento: 02/01/2025
Cos'è Opfolda?
Opfolda è un farmaco a base del principio attivo
Miglustat, appartenente alla categoria degli
Metabolici: regolatori metabolici diversi e nello specifico
Prodotti vari dell'apparato gastrointestinale e metabolismo. E' commercializzato in Italia dall'azienda
Amicus Therapeutics S.r.l..
Opfolda può essere prescritto con Ricetta RR - medicinali soggetti a prescrizione medica.
Opfolda può essere prescritto con Ricetta RR - medicinali soggetti a prescrizione medica.
Confezioni
Opfolda 65 mg 4 capsule rigide
Informazioni commerciali sulla prescrizione
Titolare: Amicus Therapeutics Europe Limited
Concessionario: Amicus Therapeutics S.r.l.
Ricetta: RR - medicinali soggetti a prescrizione medica
Classe: H
Principio attivo: Miglustat
Gruppo terapeutico: Metabolici: regolatori metabolici diversi
ATC: A16AX06 - Miglustat
Forma farmaceutica: capsula
Concessionario: Amicus Therapeutics S.r.l.
Ricetta: RR - medicinali soggetti a prescrizione medica
Classe: H
Principio attivo: Miglustat
Gruppo terapeutico: Metabolici: regolatori metabolici diversi
ATC: A16AX06 - Miglustat
Forma farmaceutica: capsula
Se sei un professionista, potrai trovare le schede tecniche complete e molto altro nell'area riservata di Codifa.it
Indicazioni
Perché si usa Opfolda? A cosa serve?
Opfolda (Miglustat) è uno stabilizzatore enzimatico della cipaglucosidasi alfa per la terapia enzimatica sostitutiva a lungo termine in pazienti adulti con malattia di Pompe a esordio tardivo (deficit di α-glucosidasi acida [GAA]).
Posologia
Come usare Opfolda: Posologia
Il trattamento deve essere supervisionato da un medico esperto nella gestione di pazienti con malattia di Pompe o altre malattie metaboliche o neuromuscolari ereditarie.
Miglustat capsule rigide da 65 mg deve essere usato in associazione con cipaglucosidasi alfa. Prima di assumere miglustat si deve consultare il Riassunto delle caratteristiche del prodotto (RCP) della cipaglucosidasi alfa.
Posologia
Per gli adulti di età pari o superiore a 18 anni, la dose raccomandata è da assumere per via orale ogni due settimane ed è basata sul peso corporeo:
- Per i pazienti con peso corporeo ≥ 50 kg, la dose raccomandata è di 260 mg (4 capsule da 65 mg).
- Per i pazienti con peso corporeo compreso tra ≥ 40 kg e < 50 kg, la dose raccomandata è di 195 mg (3 capsule da 65 mg).
Le capsule rigide di miglustat da 65 mg devono essere assunte circa 1 ora, ma non più di 3 ore prima dell'inizio dell'infusione di cipaglucosidasi alfa.
Figura 1. Tempistica della dose
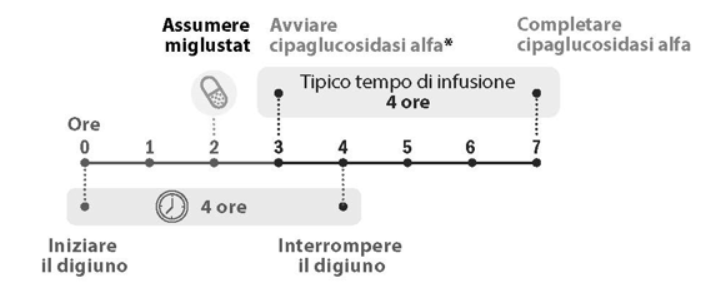
* Le capsule rigide di miglustat da 65 mg devono essere assunte circa 1 ora, ma non più di 3 ore prima dell'inizio dell'infusione di cipaglucosidasi alfa.
La risposta dei pazienti al trattamento deve essere valutata di routine sulla base di una valutazione globale di tutte le manifestazioni cliniche della malattia. In caso di risposta insufficiente o di rischi intollerabili per la sicurezza, si deve prendere in considerazione l'interruzione del trattamento con capsule rigide di miglustat da 65 mg in associazione con cipaglucosidasi alfa. Entrambi i prodotti medicinali devono essere continuati o interrotti.
Dose dimenticata
Se la dose di miglustat viene dimenticata, il trattamento deve avvenire appena possibile. Se non viene assunta, non avviare l'infusione di cipaglucosidasi alfa. L'infusione di cipaglucosidasi alfa può iniziare 1 ora dopo l'assunzione di miglustat.
Popolazioni speciali
Insufficienza renale ed epatica
La sicurezza e l'efficacia di miglustat in associazione con cipaglucosidasi alfa non sono state valutate in pazienti con compromissione renale e/o epatica. Con la somministrazione ogni due settimane, non si prevede che l'esposizione a concentrazioni plasmatiche di miglustat aumentate a causa di una compromissione renale o epatica moderata o grave influisca sensibilmente sull'esposizione alla cipaglucosidasi alfa e nemmeno che influisca sull'efficacia e la sicurezza della cipaglucosidasi alfa in modo clinicamente significativo. Non è richiesto alcun aggiustamento della dose nei pazienti con insufficienza renale o epatica.
Anziani
L'esperienza relativa all'uso della terapia di associazione a miglustat e cipaglucosidasi alfa nei pazienti di età superiore ai 65 anni è limitata. Per i pazienti anziani non è richiesto alcun aggiustamento della dose.
Popolazione pediatrica
La sicurezza e l'efficacia di miglustat in associazione con cipaglucosidasi alfa in pazienti pediatrici di età inferiore a 18 anni non sono state ancora determinate. Non vi sono dati disponibili.
Modo di somministrazione
Miglustat è per uso orale.
La capsula rigida di miglustat è dotata di pieghettature per prevenire l'apertura dell'involucro della capsula e deve essere deglutita intera e assunta a stomaco vuoto.
I pazienti dovranno restare a digiuno 2 ore prima e 2 ore dopo l'assunzione delle capsule rigide di miglustat da 65 mg (vedere paragrafo 5.2). Durante questo periodo di digiuno di 4 ore, si può consumare acqua, latte vaccino senza grassi (scremato) e tè o caffè senza panna, zuccheri o dolcificanti. Il paziente può riprendere ad alimentarsi (cibo e bevande) normalmente 2 ore dopo l'assunzione di miglustat.
Controindicazioni
Quando non dev'essere usato Opfolda
Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti elencati al paragrafo 6.1.
Controindicazioni alla cipaglucosidasi alfa.
Avvertenze speciali e precauzioni di impiego
Cosa serve sapere prima di prendere Opfolda
L'uso di Miglustat in associazione con cipaglucosidasi alfa può determinare la manifestazione di reazioni avverse al farmaco (vedere paragrafo 4.8).
Interazioni con altri medicinali e altre forme di interazione
Quali farmaci o alimenti possono modificare l'effetto di Opfolda
Non sono stati effettuati studi di interazione correlati all'uso di miglustat.
Interazioni con gli alimenti
Miglustat è noto avere un effetto diretto sulla funzione enzimatica delle principali disaccaridasi dell'epitelio intestinale. Nello specifico, miglustat inibisce le disaccaridasi con legami alfa-glicosidici, tra cui la saccarasi, la maltasi e l'isomaltasi. L'intensità delle eventuali interazioni può interferire immediatamente con l'attività digestiva del saccarosio, del maltosio e dell'isomaltosio, determinando cattiva digestione, afflusso osmotico di acqua, aumento della fermentazione e produzione di metaboliti irritanti. I pazienti devono rimanere a digiuno nelle 2 ore precedenti e le 2 ore successive all'assunzione di miglustat.
Fertilità, gravidanza e allattamento
Contraccezione femminile
Le donne in età fertile devono usare misure contraccettive affidabili durante il trattamento con Miglustat in associazione con cipaglucosidasi alfa e nelle 4 settimane successive all'interruzione del trattamento (vedere paragrafo 5.3). Il prodotto medicinale non è raccomandato nelle donne in età fertile che non utilizzano misure contraccettive affidabili.
Gravidanza
Non esistono dati clinici sull'uso di miglustat in associazione con cipaglucosidasi alfa nelle donne in gravidanza. Miglustat attraversa la placenta. Gli studi sugli animali su miglustat in monoterapia, nonché in associazione con cipaglucosidasi alfa, hanno dimostrato una tossicità riproduttiva (vedere paragrafo 5.3). La terapia di associazione miglustat e cipaglucosidasi alfa non è raccomandata durante la gravidanza.
Allattamento
Non è noto se miglustat e cipaglucosidasi alfa vengano escreti nel latte materno (vedere paragrafo 5.3). I dati farmacodinamici/tossicologici disponibili ottenuti negli animali hanno dimostrato la secrezione/escrezione di miglustat e cipaglucosidasi alfa nel latte. Il rischio per i neonati/lattanti non può essere escluso. Si deve decidere se interrompere l'allattamento o interrompere la terapia/astenersi dalla terapia con la associazione miglustat e cipaglucosidasi alfa tenendo in considerazione il beneficio dell'allattamento per il bambino e il beneficio della terapia per la donna.
Fertilità
Non esistono dati clinici sugli effetti di miglustat in associazione con cipaglucosidasi alfa sulla fertilità. Dati preclinici ottenuti nei ratti hanno dimostrato che miglustat influisce negativamente sui parametri degli spermatozoi (motilità e morfologia), riducendo quindi la fertilità, vedere paragrafo 5.3. Tuttavia, in 7 uomini adulti sani che hanno ricevuto 100 mg di miglustat per via orale, due volte al giorno per 6 settimane, non è stato osservato alcun effetto sulla concentrazione, la motilità o la morfologia degli spermatozoi.
Effetti sulla capacità di guidare veicoli e sull'uso di macchinari
Miglustat non altera o altera in modo trascurabile la capacità di guidare veicoli e di usare macchinari.
Effetti indesiderati
Quali sono gli effetti collaterali di Opfolda
Riassunto del profilo di sicurezza
La reazione avversa più comunemente riportata attribuibile solo a Miglustat 65 mg è stata la stipsi (1,3%).
Tabella delle reazioni avverse
La valutazione delle reazioni avverse è avvenuta grazie alle segnalazioni di soggetti trattati con miglustat in associazione con cipaglucosidasi alfa nell'ambito dell'analisi aggregata di sicurezza in 3 sperimentazioni cliniche. La durata media totale dell'esposizione è stata di 28,0 mesi.
Le reazioni avverse sono elencate in base alla classificazione per sistemi e organi secondo MedDRA nella Tabella 1.
Le corrispondenti categorie di frequenza sono definite come segue: molto comune (≥ 1/10), comune (da ≥ 1/100 a < 1/10), non comune (da ≥ 1/1 000 a < 1/100), rara (da ≥ 1/10 000 a < 1/1 000), molto rara (< 1/10 000) e non nota (la frequenza non può essere definita sulla base dei dati disponibili).
Tabella 1. Riassunto delle reazioni avverse di pazienti trattati con miglustat
|
Classificazione per sistemi e organi (SOC)
|
Frequenza
|
Reazione avversa (termine preferito)
|
|
Disturbi del sistema immunitario
|
Comune
|
Reazione anafilattica7
|
|
Non comune
|
Ipersensibilità
|
|
|
Patologie del sistema nervoso
|
Molto comune
|
Cefalea
|
|
Comune
|
Tremore, disgeusia, parestesia
|
|
|
Non comune
|
Disturbi dell'equilibrio, emicrania4
|
|
|
Patologie cardiache
|
Comune
|
Tachicardia6
|
|
Patologie vascolari
|
Comune
|
Ipotensione
|
|
Non comune
|
Pallore
|
|
|
Patologie respiratorie, toraciche e mediastiniche
|
Comune
|
Dispnea
|
|
Non comune
|
Asma
|
|
|
Patologie gastrointestinali
|
Comune
|
Diarrea, nausea, dolore addominale1, flatulenza, distensione addominale, vomito, stipsi†
|
|
Non comune
|
Fastidio addominale†, spasmo esofageo, dolore orale
|
|
|
Patologie della cute e del tessuto sottocutaneo
|
Comune
|
Orticaria3, eruzione cutanea2, prurito, iperidrosi
|
|
Non comune
|
Alterazione del colore della pelle
|
|
|
Patologie del sistema muscoloscheletrico e del tessuto connettivo
|
Comune
|
Spasmi muscolari, mialgia, artralgia, debolezza muscolare
|
|
Non comune
|
Dolore al fianco, affaticamento muscolare, rigidità muscoloscheletrica
|
|
|
Patologie sistemiche e condizioni relative alla sede di somministrazione
|
Comune
|
Stanchezza, piressia, brividi, edema periferico
|
|
Non comune
|
Astenia, dolore al viso, sensazione di agitazione†, dolore toracico non cardiaco
|
|
|
Esami diagnostici
|
Comune
|
Pressione arteriosa aumentata5
|
|
Non comune
|
Riduzione della conta linfocitaria, riduzione della conta piastrinica†
|
† Segnalata solo con miglustat
1 Dolore addominale, dolore addominale dei quadranti superiori e dolore addominale dei quadranti inferiori sono raggruppati sotto dolore addominale.
2 Eruzione cutanea ed eruzione cutanea eritematosa sono raggruppate sotto eruzione cutanea.
3 Orticaria, eruzione orticarioide e orticaria meccanica sono raggruppate sotto orticaria.
4 Emicrania ed emicrania con aura sono raggruppate sotto emicrania.
5 Ipertensione e aumento della pressione arteriosa sono raggruppate sotto pressione arteriosa aumentata.
6 Tachicardia e tachicardia sinusale sono raggruppate sotto tachicardia.
7 Anafilassi, reazione anafilattica e reazione anafilattoide sono raggruppate sotto reazione anafilattica.
Segnalazione delle reazioni avverse sospette
La segnalazione delle reazioni avverse sospette che si verificano dopo l'autorizzazione del medicinale è importante, in quanto permette un monitoraggio continuo del rapporto beneficio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite
Agenzia Italiana del Farmaco Sito web: https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.
Sovradosaggio
Cosa fare se avete preso una dose eccessiva di Opfolda
Sintomi
Leucopenia, granulocitopenia, neutropenia, capogiri e parestesie sono stati osservati in pazienti con infezione da virus dell'immunodeficienza umana (HIV)trattati con Miglustat ad un dosaggio pari o superiore a 800 mg/die.
Gestione
In caso di sovradosaggio, deve essere fornita immediatamente assistenza medica di supporto. L'emocromo completo deve essere monitorato per la riduzione dei leucociti.
Scadenza
3 anni
Conservazione
Questo medicinale non richiede alcuna condizione particolare di conservazione.
Foglietto Illustrativo
Fonti Ufficiali
© 2022 EDRA S.p.A. - P.iva 08056040960
DPO - dpo@lswr.it